Las claves de los «detectives» del cáncer hereditario: «Saber que tienes una mutación puede salvarte la vida»
ENFERMEDADES
Analizamos cuáles son los tumores hereditarios más frecuentes y qué medidas de prevención existen en aquellos casos en los que la persona es portadora de una mutación, pero no ha desarrollado la enfermedad
16 jun 2025 . Actualizado a las 10:09 h.«¿Qué hago si he heredado una mutación que aumenta el riesgo de cáncer?». Esa es la pregunta a la que intentan responder los «detectives» del cáncer familiar. Buscar en árboles genealógicos a integrantes que pueden haber heredado mutaciones que aumentan el riesgo de cáncer. La unidad de Cáncer Familiar del Centro Nacional de Investigaciones Oncológicas (CNIO) estudia cerca de 600 casos al año. Más de una cuarta parte son personas sanas que tienen a un familiar con cáncer, en quien se ha identificado una alteración genética que aumenta las probabilidades.
María Currás, jefa de esta unidad clínica, matiza términos en los que suele existir confusión antes de entrar en materia. «Hablamos de cáncer familiar cuando existe una agregación de casos de tumores en el linaje, pero no se ha identificado una mutación que lo cause. El tipo hereditario cumple esos criterios, pero además conocemos la causa genética que le ha dado lugar». Se calcula que del 70 al 80 % de los cánceres son esporádicos, causados por factores ambientales, hábitos de vida y envejecimiento. De un 15 a un 20 % de los casos se observa agregación familiar de uno o varios tipos concretos de cánceres y del 5 al 10 % son de susceptibilidad genética heredada.


Diferenciando mutaciones genéticas de las del tumor
«El cáncer no se hereda, sino una alteración genética en un gen concreto que hace que sea más probable que se desarrolle un tipo de cáncer. Esas alteraciones se pueden transmitir a los hijos si están presentes en el óvulo o en el espermatozoide. En estos casos, la mutación está en línea germinal», apunta Ana Beatriz Sánchez, coordinadora de la sección de la Sociedad Española de Oncología Médica (SEOM) de Cáncer Familiar y Hereditario. Según sus palabras, se conocen unos 200 genes que pueden causar predisposición a cáncer, «con gran variabilidad de riesgo: alto, moderado y medio a bajo; siendo la mayoría muy poco frecuentes».

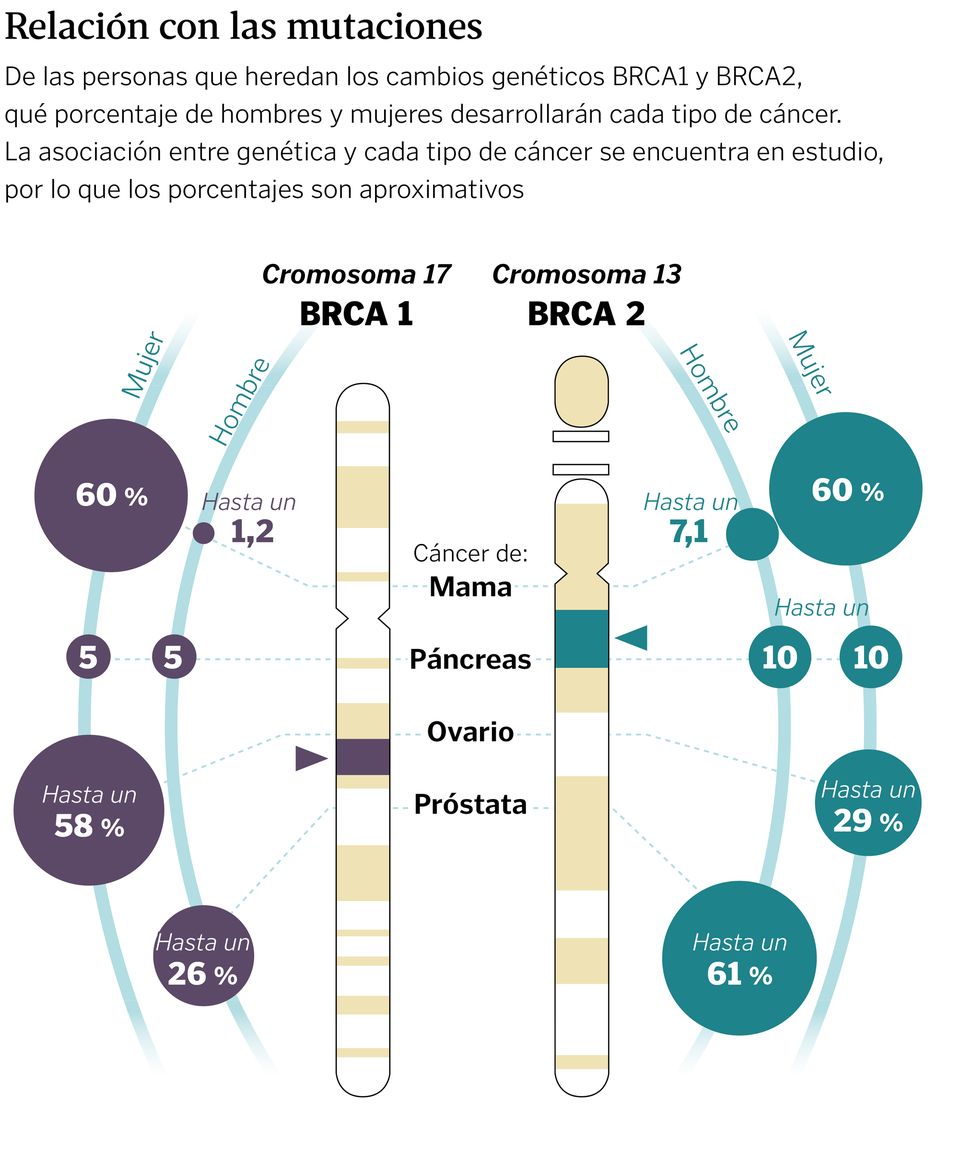
Jesús Bañales, investigador y catedrático de Ciencias de la Universidad de Navarra, expone que «genes como BRCA1 y BRCA2 son supresores tumorales, es decir, ayudan a controlar el crecimiento celular y prevenir la formación de tumores; actúan como un freno». Cuando existe una mutación en los mismos, este freno puede dejar de funcionar. «En consecuencia, personas que tienen estas mutaciones ven cómo aumenta su riesgo de diferentes tumores epiteliales como el de mama, ovario, biliar, etcétera», amplía el experto.
Así, también es necesario diferenciar entre estas mutaciones genéticas que se heredan y pueden aumentar el riesgo de cáncer, de las adquiridas que se desarrollan durante la vida de una persona. «El inicio del cáncer se debe a daños sucesivos en el material genético o ADN de una célula, producido por sustancias químicas, radiaciones, infecciones, tipo de alimentación, alteraciones del metabolismo o incluso el envejecimiento. Dan lugar a mutaciones que facilitan la multiplicación celular descontrolada y posterior invasión de tejidos vecinos o a distancia». Conocer las mutaciones genéticas que tiene un cáncer es fundamental: «Permite individualizar el tratamiento para obtener mejores resultados de curación o remisión», añade.
Una persona puede ser considerada de alto riesgo si se confirma que es portadora de una variante patogénica en un gen de alto riesgo asociado a un determinado tipo de cáncer.
- Para cáncer de mama en los genes: BRCA1, BRCA2, TP53, STK11, PTEN, y alto-moderado riesgo en CDH1, PALB2.
- Para cáncer de ovario en los genes BRCA1 y BRCA2.
- Para cáncer de colon en los genes MLH1, MSH2, APC.
- Para cáncer de endometrio en los genes MLH1, MSH2, MSH6.
- Para paragangliomas/feocromocitomas en los genes SDHB, SDHD, RET, VHL.
Fuente: SEOM
Los cánceres con mayor predisposición genética en nuestro país
«En cifras absolutas, lo más frecuente es en cáncer de mama. Se estima que del 5 al 10 % se deben a predisposición genética», sostiene Sánchez. Teniendo en cuenta que para este 2025 se estima que se diagnosticarán 37.682 casos de cáncer de mama —según el informe Las cifras del cáncer en España, elaborado por la SEOM en colaboración con la Red Española de Registros de Cáncer—, por regla de tres de 1.884 a 3.768 serán por predisposición genética.
Le sigue el cáncer colorrectal. «Se estiman 44.573 nuevos casos para 2025, de los cuales el 5 % aproximadamente, 2.228 casos, se deberán a predisposición genética», indica la oncóloga. Además, «un 40 % de los paragangliomas y feocromocitomas se deben a predisposición genética hereditaria, pero su incidencia es muy baja, de 0,66 casos por cada 100.000 habitantes, por lo que en cifras absolutas son poco frecuentes».

Cuándo se sospecha alto riesgo hereditario
«Se debería sospechar que hay posibilidad de un cáncer hereditario si el tumor aparece a una edad joven. Por ejemplo, cáncer de colon con menos de 50 o 55 años, o de mama con menos de 40», sostiene Currás. También si desarrolla tumores múltiples o «si el paciente tiene familiares que han tenido el mismo tumor o los que llamamos relacionados: sabemos que hay grupos de tumores que si van juntos nos orientan hacia un síndrome particular, una causa común hereditaria», añade. Por ejemplo, el síndrome de Cáncer de Mama y Ovario Hereditarios (CMOH), los síndromes de Lynch y de Cowden, la Poliposis Adenomatosa Familiar (PAF), la neoplasia endocrina Múltiple o la neurofibromatosis.
Así, se lleva a cabo un estudio genético cuando la persona cumple características que hacen sospechar a la comunidad médica que es portadora de una alteración genética de susceptibilidad al cáncer. «Los criterios para hacerlo varían según el tipo de tumor y la edad de diagnóstico, si hay dos o más casos en familiares de primer grado, o cuando ya hay un diagnóstico genético familiar confirmado y es probable que comparta la característica genética», asegura la oncóloga.
Con todo, también es posible realizarlo para buscar oportunidades de tratamientos específicos y personalizados mediante tratamientos dirigidos. «Hay tumores que, por sí solos, como el de ovario o de páncreas, es indicación de hacer estudio genético independientemente de la edad», dice Currás. También sucede en algunos casos de mama.
Según la SEOM, toda persona que sepa que en su familia existe varios casos de cáncer debería acudir a su médico de atención primaria para una primera valoración. Si este considera que los datos sugieren un trastorno hereditario, deberá remitirle a la unidad de consejo genético más cercana. En España, existen más de cien. En Galicia, hay nueve: Fundación Pública Galega de Medicina Xenómica, Complexo Hospitalario Universitario de A Coruña (Chuac), Hospital Materno Infantil Teresa Herrera (A Coruña), Hospital Arquitecto Mardice (Ferrol), Hospital Clínico Universitario de Santiago (CHUS), Hospital Lucus Augusti (Lugo), Complexo Hospitalario Universitario de Pontevedra (CHUP), Complexo Hospitalario Universitario de Ourense (CHUO) y Complejo Hospitalario Universitario de Vigo (Chuvi).
¿Y si el test genético sale positivo?
«En las personas con susceptibilidad genética confirmada, dependiendo del gen alterado hay protocolos diferentes», avanza la oncóloga. «Por ejemplo, para BRCA1 y BRCA2 en mujer se recomienda resonancia magnética mamaria anual a partir de los 25 a los 30 años junto con mamografías anualmente a partir de los 40 y exploración ginecológica mediante ecografía trnavaginal a partir de los 30 años hasta el momento de la decisión de cirugía preventiva (que no debe hacerse nunca antes de los 35 a 40 años)», explica. En el caso de los hombres, la doctora indica que el riesgo para BRCA 2 es de cáncer de próstata. «Ahí se recomienda la determinación del PSA en sangre y la realización de exploración prostática, anualmente a partir de los 40 años».
Más allá de esos dos genes, que son los más frecuentes, la doctora menciona el gen CHEK2 de moderado riesgo de cáncer de mama en mujer, se recomiendan mamografías anualmente, con o sin resonancia magnética mamaria, a partir de los 40 años». Así como para el MLH1 y MSH2, «que se recomienda cribado de cáncer de colon mediante colonoscopia cada uno o dos años a partir de los 25». Y remarca: «Los protocolos son diferentes según el gen alterado y los riesgos asociados».
Cuando existen antecedentes fuertes, pero no se identifica alteración genética responsable «no se puede decir que es ‘’negativo’’; son casos para volver a estudiar según los avances de los conocimientos». Y si se tiene una alteración que has heredado, «esto te confiere más riesgo que la población general para poder desarrollar un tumor, pero eso no quiere decir que sí o sí vaya a suceder», matiza Currás, que tambíén subraya: «Saber que tienes una mutación puede salvarte la vida».

Medidas de prevención: del diagnóstico precoz a la cirugía profiláctica
La primera medida de prevención, en realidad, debería ser llevada a cabo por toda la población. «Seguir estilos de vida sanos y evitar factores de riesgo: alimentación, ejercicio físico y evitar carcinógenos», recomienda Sánchez. Entre estos últimos se encuentra el tabaco, el exceso de radiaciones ultravioletas, padecer obesidad y consumir productos ultra procesados.
A nivel clínico se establecen recomendaciones de diagnóstico precoz, como la mamografía, la resonancia magnética mamaria o la colonoscopia; según el protocolo para cada tipo de alteración genética. «También existen cirugías reductoras de riesgo como la extirpación de glándulas mamarias, de ovarios y trompas uterinas, de colon, etcétera», añade.
La intervención profiláctica tiene aplicación en Polimatosis Adenomatosa Familiar (PAF), Cáncer de Mama y Ovario Hereditarios (CMOH) y en menor medida en el síndrome de Lynch. «Se aconseja en casos en los que el riesgo de desarrollar el tumor es del 50 % o superior. Antes era más frecuente. Ahora, cada vez más, se intenta ser lo más conservador posible», amplía Currás. Un ejemplo es la extirpación de la vesícula que se daba en aquellos individuos con riesgo de padecer cáncer de vías biliares. «Aunque es una cirugía segura, todo tiene un riesgo. Se puede hacer una vida normal sin ella, pero ahora solo se quita en circunstancias muy concretas, como cuando ya se da inflamación y dolor», indica Bañales.
En los genes BRCA1 y BRCA2 la extirpación de ovarios y trompas uterinas reduce el riesgo de cáncer de ovario de un 95 a un 97 %. «Se recomienda realizarlo de los 40 a los 45 años de edad, una vez completado el deseo de maternidad», indica Sánchez. La situación es similar en el caso de las glándulas mamarias. «Su extirpación reduce el riesgo de cáncer de mama en un 90 a un 95 % y, aunque no hay indicación de edad límite, por encima de los 55 años el beneficio esperado es menor», añade. Además, a día de hoy se llevan a cabo técnicas mucho menos invasivas para reducir el impacto físico y psicológico que puede darse en las pacientes.

Para el gen APC que se relaciona con la poliposis adenomatosa familiar (PAF), causante de menos de 1 % de los cánceres de colon y recto, «la extirpación total reduce casi al 100 % el riesgo de desarrollar el tumor, pero tinee consecuencias y secuelas con merma de calidad importante», asegura la oncóloga de la SEOM. «Por ello, las indicaciones de cirugías preventivas se valorarán habitualmente por un comité de expertos y se debe asesorar adecuadamente a la persona para que tome la decisión».
Los retos
La cartera común de servicios del Sistema Nacional de Salud se ha actualizado recientemente con un catálogo de mínimos de pribeas genéticas y genómicas que debe ser cumplido por todas las comunidades autónomas. «Es el primer paso para conseguir la equidad asistencial para todos los ciudadanos», sostiene Sánchez. Además, lamenta que a día de hoy «no tenemos registros nacionales oficiales (de las administraciones) de cáncer hereditario que nos permitan conocer la realidad de este problema y así poder planificar mejor la asisencia sanitaria».
A nivel de investigación, Currás, explica: «De todas las variantes que nos podemos llegar a encontrar, hay unas que llamamos de significado desconocido. Son sobre las que no tenemos suficiente información a nivel de predictores, función de proteína o incluso artículos publicados para saber si es de riesgo o no. Eso al paciente le geenera intranquilidad, porque le piedes decir que has encontrado una mutación, pero una variante que no sabes exactamente qué es». Si bien la especialista recalca la sencillez y efectividad de un proceso que resulta muy esclarecedor para este pacientes y familiares: «No es más que un análisis de sangre y una consulta en la que se preguntan los antecedentes familiares, y es muy informativo para ellos».