Voluntarios do presente para pacientes do futuro: a radiografía dos ensaios clínicos no noso país

A CAIXA DE PRIMEIROS AUXILIOS

España é o país de Europa onde máis investigacións deste tipo aprobáronse no 2024, sendo o cancro protagonista do 39% dos estudos realizados. En xeral, a representación das mulleres adoita ser inferior á dos homes: un terzo de todos os participantes, unha problemática sobre a que pon o foco diferentes institucións
20 oct 2025 . Actualizado á 11:26 h.España volveu converter no 2024 no país coa maior capacidade de atracción de investigación clínica de medicamentos da Unión Europea. Segundo o Rexistro Español de Estudos Clínicos (REec), a Axencia Española de Medicamentos e Produtos Sanitarios (AEMPS) autorizou o ano pasado un total de 930 estudos, alzándose como a axencia reguladora europea que máis ensaios clínicos aprobou. Detrás destas cifras existe un traballo coordinado e continuo entre diferentes axentes que fan posible que esa terapia ou fármaco acábese aprobando e administrado naqueles pacientes que o necesiten.
Un ensaio clínico é unha investigación en seres humanos para demostrar a eficacia ou seguridade dun medicamento. Así o define, de forma resumida, Juan Estévez, xefe da División de Ensaios Clínicos da AEMPS. Para que poidan porse en marcha, deben cumprirse unha serie de criterios. O primeiro é a autorización por parte da autoridade competente. «Neste caso, somos nós os que a outorgamos. Hai un proceso de avaliación científica por parte da axencia e de ética, por parte dun comité», explica. Poden levar a cabo por iniciativa comerical ou non. «Detrás desta última pode haber un investigador, unha fundación ou outro tipo de promotor; son o 20% dos ensaios, o resto, son propostos pola industria farmacéutica».
As distintas fases dos ensaios clínicos
A investigación clínica pasa por distintas etapas. Na primeira, coñecida como fase I, participan uns poucos voluntarios (de vinte a trinta, aproximadamente), para confirmar que a administración do fármaco é segura. Na fase II comezan as análises de seguridade desas doses e, por tanto, o grupo de participantes tamén aumenta, podendo chegar a unhas 200 ou 300 persoas. Estúdase tamén a seguridade coas doses exploradas. Cando o propósito é a confirmación da eficacia dun fármaco, o ensaio considérase de fase III. Neste caso xa participan miles de persoas e o obxectivo xa é obter datos precisos para a solicitude dunha autorización de comercialización.

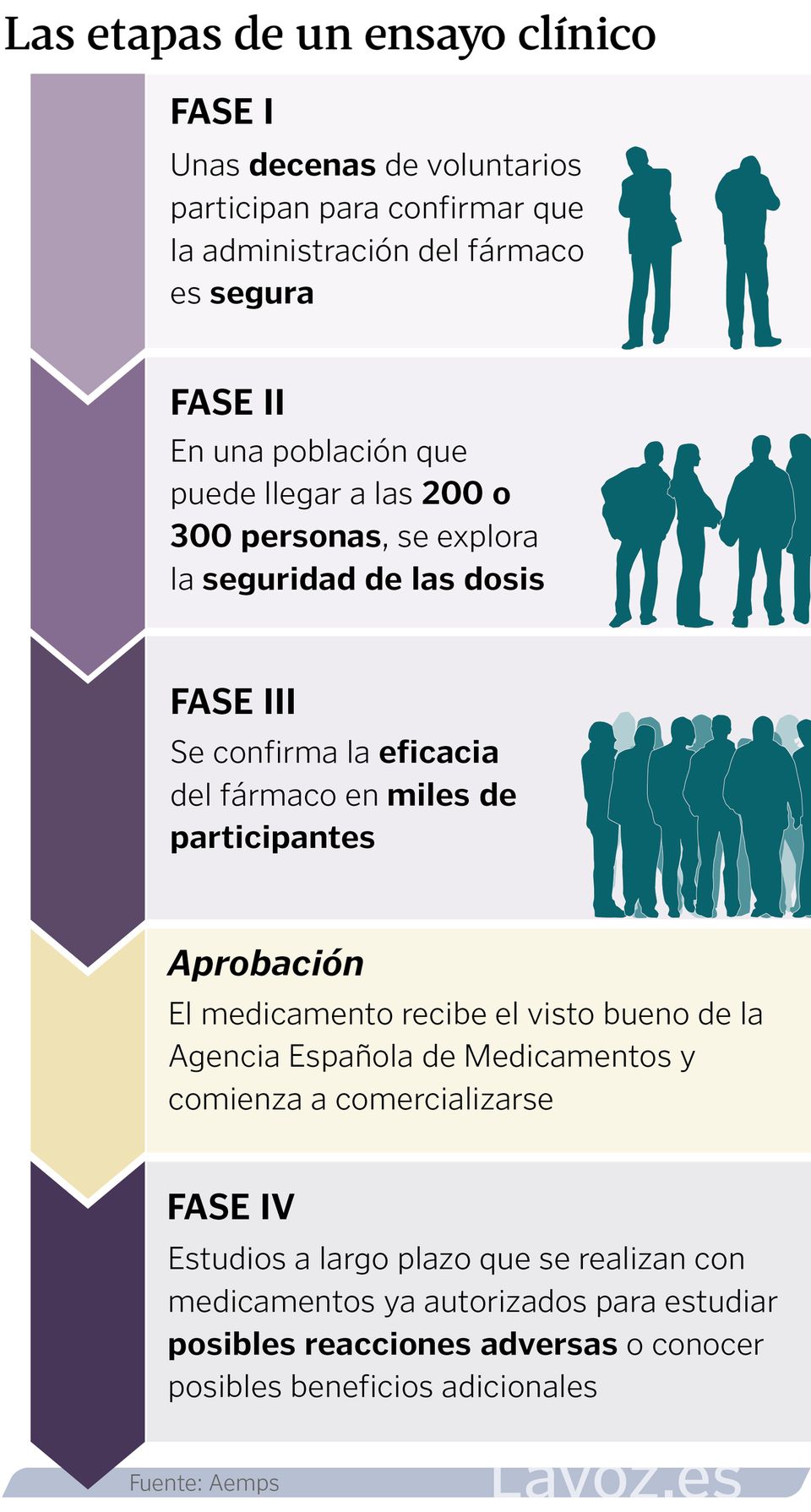
Pode dicirse que os ensaios máis particulares son os de fase IV. Estes xa son a longo prazo con medicamentos que están autorizados, para estudar posibles reaccións adversas ou incluso coñecer posibles beneficios adicionais. «Ao final, en farmacoloxía, canto máis amplías a poboación, que é o que sucede cando se autoriza, contas con máis posibilidades para poder buscar problemas de seguridade que non aparecesen ata o momento, ou que busques eficiencias no sistema, mellorando, por exemplo, dose ou pauta», amplía Estévez.
Con todo, o xefe da División de Ensaios Clínicos da AEMPS matiza que «ao final o determinante non é o título que se lle dea ao estudo, se o chamas de fase II ou III, porque ningúns incluso poden estar na fronteira entre unha e outra, senón que estea ben controlada a seguridade dos suxeitos e que os datos que se xeren sexan o suficientemente robustos».

Que sucede se o ensaio clínico sae ben (ou mal)
«O proceso de xeración de datos e de autorización é complexo», avanza Estévez. «Para intentar resumilo, cabe dicir que, con cada ensaio clínico que finaliza, independentemente de como se faga, tense que xerar un informe de resultados porque isto nos permite, se funciona ben, entendelo mellor e se saíu mal, tamén, para despois telo en conta en futuras autorizacións de ensaio clínico».
Para presentar unha autorización de comercialización, hai varias vías. «A máis coñecida é a centralizada: preséntase á Axencia Europea de Medicamentos (EMA), a cal coordina o procedemento e as axencias nacionais achegan avaliadores que estudan estes dossieres. Aínda que existen outros procedementos que se utilizan cada vez menos, como o nacional, que englobaría a un medicamento que só se quere autorizar no noso país; ou o recoñecemento mutuo, autorizar o fármaco só en determinados países da Unión Europea. Con todo, son procesos que, coa lexislación actual, están a quedarse moi reducidos, porque o que se busca é que toda a poboación europea póidase beneficiar de novos fármacos».
Por tanto, pondo o foco na vía centralizada, unha vez que a EMA dá o visto e prace porque o balance entre o beneficio e o risco dese fármaco é positivo, outórgase a autorización. «Despois, comeza o proceso de financiamento e prezo en cada país. No caso de España, é competencia do Ministerio de Sanidade e en función do tipo de fármaco e o seu presuposto, pódese tardar máis ou menos en dar acceso a ese fármaco. Pero este proceso, xa non é competencia da AEMPS», detalla.
Se se dá calquera tipo de complicación no ensaio clínico, a axencia ten capacidade para paralizalo e, no peor dos casos, tamén de suspendelo. «Pero o que adoita ocorrer é que é o propio promotor o que paraliza o tratamento ou recrutamento. En función da gravidade do ocorrido, incluso podería romperse o cego para que se saber que deuse aos pacientes ou que non», conta o experto. Nun ensaio de dobre cego, nin os participantes nin os investigadores saben que tratamento ou intervención están a recibir ou administrando ata que o estudo finaliza. Así, un grupo recibe a terapia que se está avaliando, mentres que o outro, un placebo que sente idéntico á terapia orixinal. Realízase desta forma para minimizar o nesgo, evitando que as expectativas inflúan nos resultados. As conclusións son máis obxectivas e fiables.

Líderes europeos en investigación para tratar o cancro
España lidera a investigación de medicamentos contra o cancro en Europa. Dos 930 ensaios clínicos aos que deu luz verde a AEMPS no 2024, 350 estaban destinados a tratar o cancro, supondo un 39% dos estudos autorizados. Charo García Campelo, xefa de servizo de Oncoloxía do Complexo Hospitalario Universitario da Coruña (Chuac) e responsable do grupo de investigación de Oncoloxía do Instituto de Investigación Biomédica da Coruña (Inibic), defíneos como «un acto de enorme xenerosidade por parte desa persoa cara a futuros pacientes, porque aínda que este accede a nova posibilidade terapéutica, tamén á incerteza de non saber como funcionará o que lle estamos propondo». Explícao desde a unidade de ensaios clínicos situada no hospital coruñés. «Agora mesmo, aquí, temos ao redor de 190 abertos, en distintos tumores sólidos: cancro de mama, colorrectal, de pulmón, melanoma... Pero tamén en diferentes etapas, desde fase I a fase III, así como estudos observacionales».

Conforme se sobe en fase, aumentan os participantes de cada estudo, pero se reduce o número de ensaios. «Os máis numerosos que temos son fase III: no 2024, foron 86; en fase II, 64; e en fase I, temos 8. Estes últimos son os máis complexos porque son os que implican máis labores en termos de seguridade e de obtención da dose eficaz e tolerable para un paciente, son os que se fan nesta unidade específica. O resto, fanse en consulta convencional». Ademais, a doutora comenta que na unidade de fase I os tumores máis frecuentes son aqueles nos que fracasaron a maioría de alternativas terapéuticas dispoñibles.
A participación nun ensaio clínico é moi rigorosa. «É lóxico que estea sometido a tanto control. Existen uns criterios de inclusión que deben ser cumpridos de forma global por ese paciente en concreto». Así mesmo, Campelo remarca que o proceso de información ten que ser claro. «O paciente ten que estar informado do que supón en termos de posible eficacia, toxicidade e beneficios».
Unha participación de mulleres menor
As mulleres participan menos en ensaios clínicos. Hai unhas semanas, un estudo levado a cabo polo Centro Nacional de Investigacións Cardiovasculares (CNIC) en colaboración coa Sociedade Española de Cardioloxía, revisou o uso de betabloqueantes tras sufrir un infarto de miocardio. Del partía un subestudio, co que agarda seguir adiante, sobre os efectos desta medicación en mulleres. Óscar Prada, cardiólogo do Complexo Hospitalario Universitario da Coruña (Chuac), en declaracións a La Voz da Saúde, remarcaba que «había que pór o foco con especial interese» na participación das mulleres neste tipo de estudos, «para ter unha información moito máis robusta» sobre a administración dalgúns fármacos: «Con algúns tratamentos pode ocorrer que a dose necesaria sexa diferente segundo o sexo, e por tanto, tamén se melloraría o efecto de certos medicamentos. Ao final, non somos iguais bioloxicamente».

O xefe da División de Ensaios Clínicos da AEMPS confirma que «é un tema que preocupa e que temos que abordar». Sinala que xa existen diferentes iniciativas por parte da axencia e incluso do Ministerio de Sanidade, para tratar «a diversidade» nos ensaios clínicos. «Aquí inclúese, efectivamente, o tipo de participación que existiu de mulleres e homes, e se se tiveron en conta os posibles efectos que poden aparecer segundo a dose».
«Hai unha participación recente que asegura que a menor participación de mulleres en ensaios clínicos é un problema, xa que a inclusión de poboación feminina en ensaios clínicos sitúase ao redor dun 30 %. Isto é un problema, porque a maioría da investigación, historicamente, xa sexa preclínica e clínica, fíxose en homes. E de aí, asumimos moitas conclusións ao redor de doses, eficacia de fármacos, tolerancia dunha determinada estratexia terapéutica ou incluso a calidade de vida que esta pode proporcionar», aborda a oncóloga Campelo. Aínda que a día de hoxe, a poboación masculina e feminina difire en moitos dos aspectos comentados. «En como se metabolizan os fármacos, cal é a dose máis adecuada ou a forma de percibir a toxicidade; por todo isto, a participación de mulleres ten que ser un tema prioritario, tanto en oncoloxía como noutras especialidades».
En canto ás razóns que poden chegar a explicar esa infrarrepresentación da poboación feminina nos ensaios englóbanse causas de exclusión históricas das mulleres nos estudos e a falsa crenza de que os corpos masculinos conformaban un modelo representativo para ambos os sexos. Aínda que a doutora Campelo engade outras que se suman á lista: «Hai distintos factores que poden explicar o baixo recrutamento das mulleres en ensaios clínicos. Isto está publicado, rexistrado e analizado. Un deles é que, ás veces, a propia muller rexeita a participación nun ensaio clínico porque este esixe moita visita ao hospital, moitos procedementos que consomen tempo, e as súas obrigacións laborais e familiares, de conciliación, poden levala a rexeitar a opción». Na súa opinión, os profesionais sanitarios como ela deben animar a que participen e «axudalas a que teñan as ferramentas necesarias para que a súa vida persoal non se vexa tan impactada como para dicir que non á investigación».