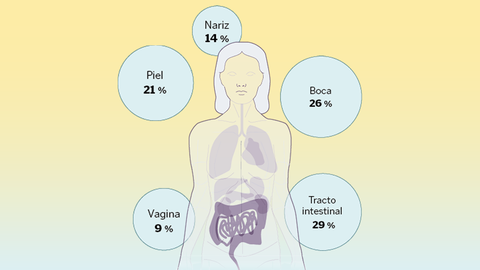
O microbioma cóntase en millóns de millóns, supera en número ás células humanas e cada vez atribúenselle máis funcións como a inmunitaria
28 sep 2025 . Actualizado á 11:11 h.Millóns de microorganismos conviven no corpo humano. Bacterias, fungos, arquexas e virus comparten espazo con células, de todo tipo, e forman un ecosistema de tal magnitude que pode dicirse, en palabras de Ignacio López-Goñi, catedrático de Microbioloxía da Universidade de Navarra, que unha persoa é metade humana, metade bacteria. «Por cada célula humana, temos unha bacteria», adianta o divulgador científico.
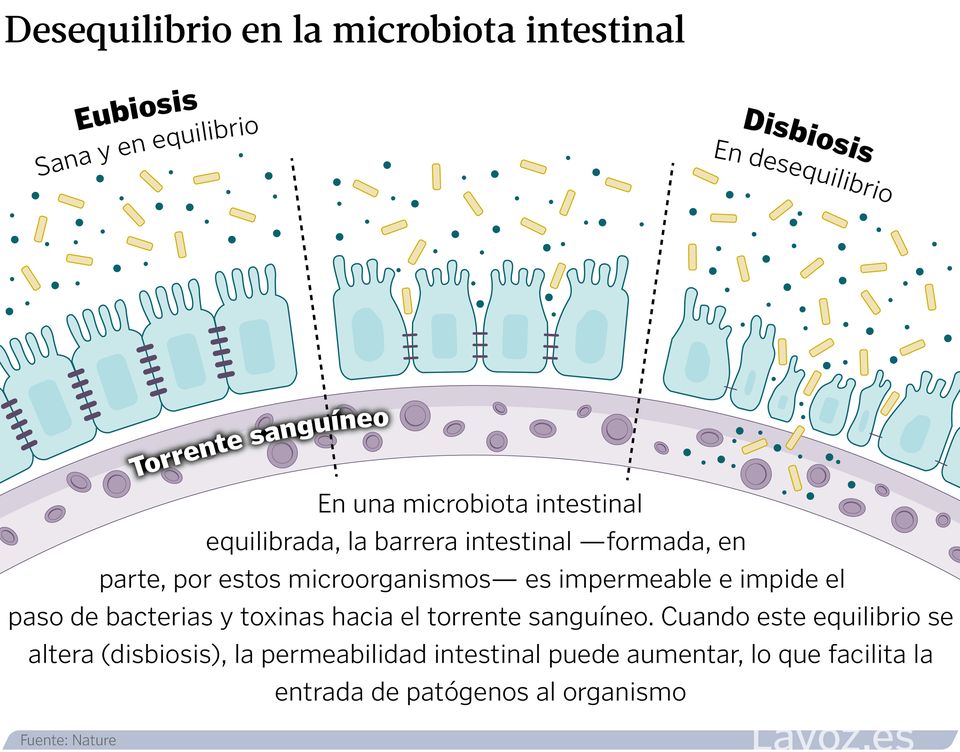
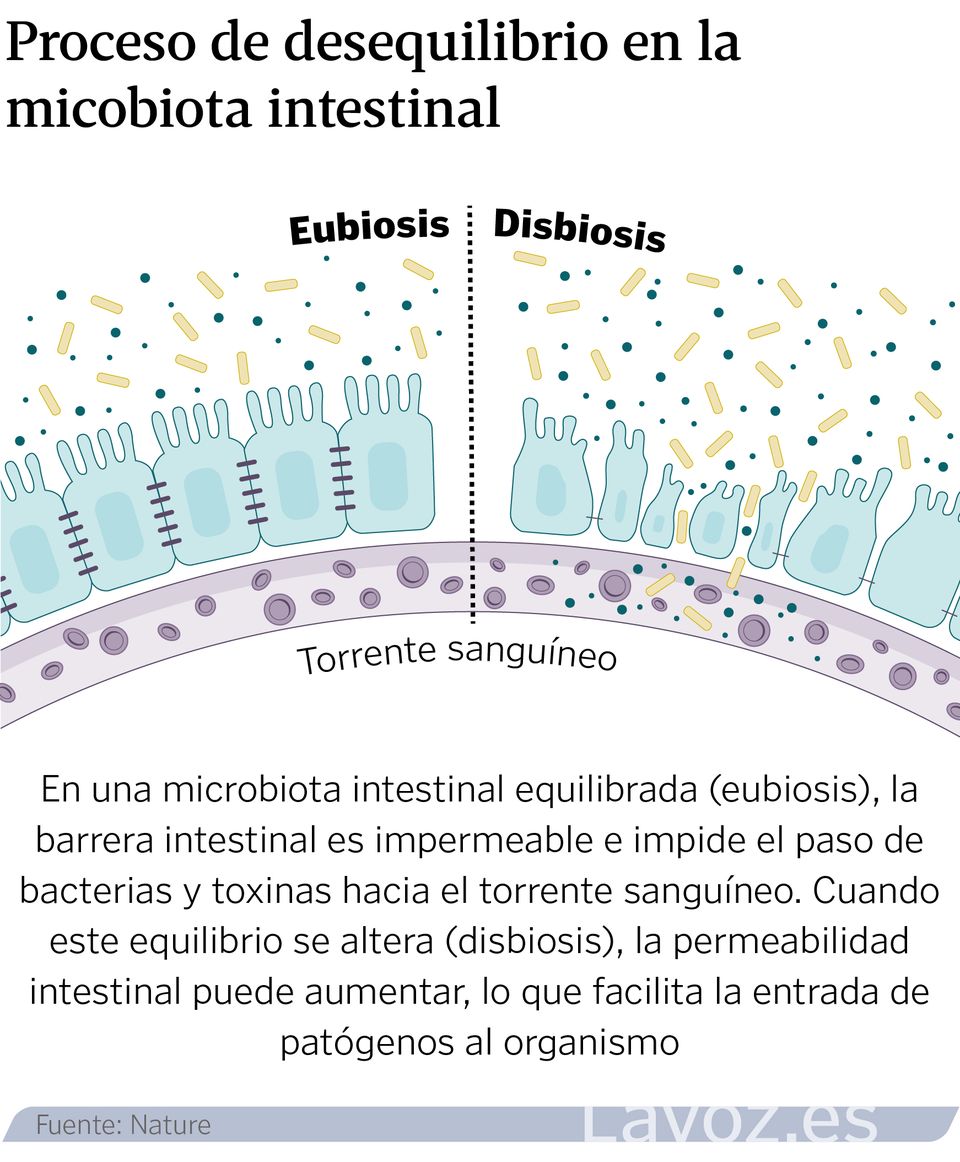
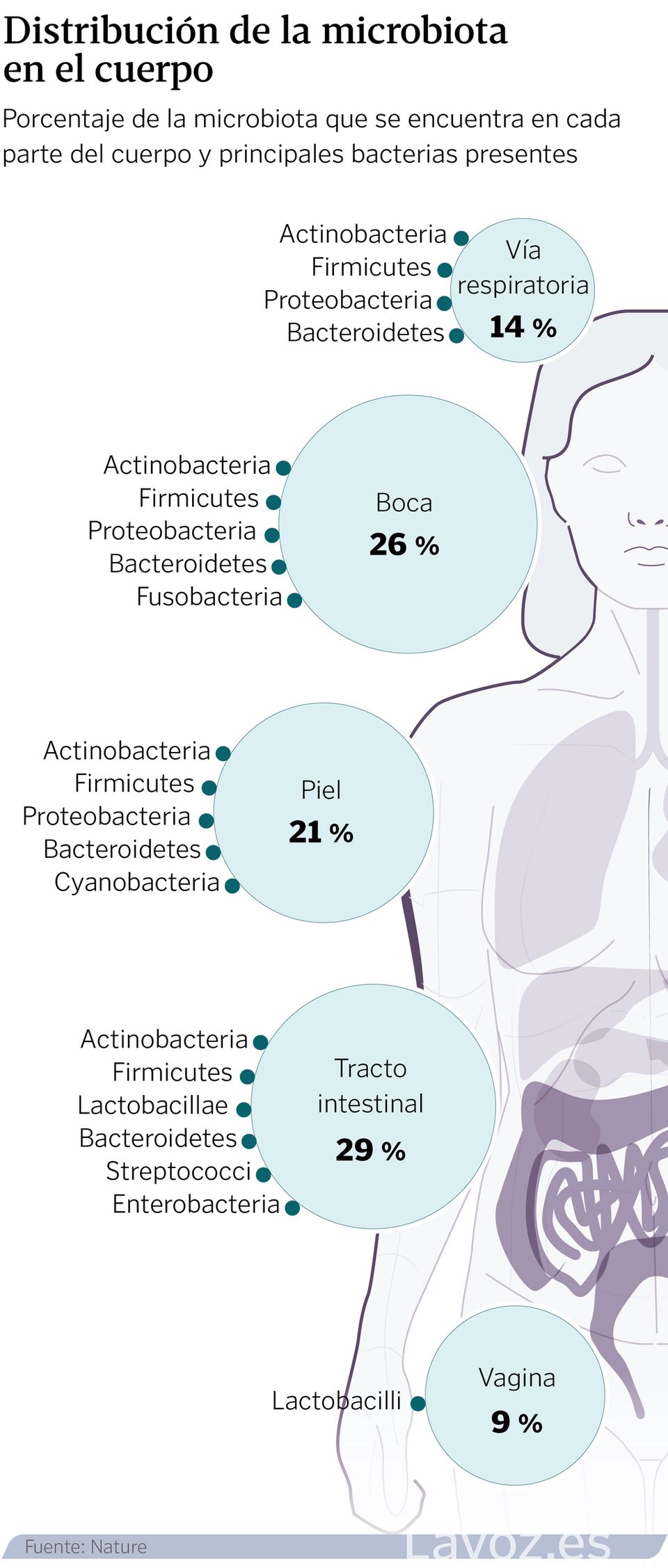
Un ecosistema que, cando está en equilibrio permite falar de saúde. Pero cando se altera e prodúcese unha disbiosis, «pódese relacionar con estados de enfermidade», indica o experto. «Non estamos sós», recoñece Aleix Lluansi, investigador do grupo de Enfermidades Infecciosas e Microbioma do Institut de Recerca Sant Joan de Déu. Por orde de habitantes, o intestino, a boca, a pel, os pulmóns e a vexiga teñen o seu propio universo de patóxenos, con nome e apelidos, que crecen e evolucionan á vez que o fai o seu hóspede.
Adoitan aloxarse, especialmente, nas capas mucosas e superficiais dos tecidos, e presentan certa capacidade para relacionarse co medio ambiente. Súmase, ademais, que estas comunidades varían en cantidade dentro dunha mesma zona. Por exemplo, son máis abundantes no tracto respiratorio superior que no inferior, ou no íleon e colon que no estómago.
Tamén sucede o contrario. Hai zonas onde o seu paso está prohibido. «O sangue é un líquido que debe ser totalmente estéril», exemplifica María Cisneros, tamén investigadora do grupo de Enfermidades Infecciosas e Microbioma do Institut de Recerca Sant Joan de Déu.
O inicio
A orixe da microbiota sitúase no momento do nacemento. A pesar de que algúns autores apuntan ao traspaso de bacterias na placenta, a teoría aceptada ata o momento é que a colonización se inicia no nacemento. O tipo de parto ten moito que dicir nesta adquisición.
Se é vaxinal, os microbios de comunidades vaxinais e fecais da nai pasan ao neno para formar parte do seu comunidade oral, gastrointestinal e cutánea. Na cesárea, son os microbios maternos da pel os que chegan ao bebé. «O nacemento implica un cambio drástico para o neonato que pasa dun ambiente con reducida carga microbiana a un ambiente cargado de millóns de microorganismos», detalla Jesús L. Romalde, profesor de microbioloxía da Universidade de Santiago de Compostela (USC).
Un dos factores de maior peso no desenvolvemento da microbiota é o tipo de alimentación do recentemente nado. «Numerosos traballos confirmaron os beneficios a curto e longo prazo da lactación materna, fronte ao uso de fórmulas infantís», engade o experto da universidade galega. A introdución de alimentos tamén conduce a «cambios significativos na composición» e a unha estabilización dos residentes, «con dominancia de grupos microbianos similares aos do adulto, aproximadamente aos dous ou tres anos», destaca o microbiólogo.
Estas primeiras etapas da vida considéranse críticas á hora de ensamblar un bo microbioma, que se desenvolve a medida que o fan órganos como o cerebro. Iso si, non todas as microbiotas seguen o mesmo patrón ou ritmo, senón que poden seguir modificándose en maior ou menor medida. Inflúe a dieta —se é rica en fibra, froitas, verduras, legumes e cereais integrais é beneficiosa—, a actividade física, o consumo de medicamentos, o estrés, a zona xeográfica, o contacto con mascotas e ata a xente coa que un se relacione.

Mireia Vallès Colomer, directora do Grupo de Investigación sobre Microbioma da Universidade Pompeu Fabra, sinala que «canto máis tempo leves vivindo cunha persoa, máis se parecen os microbiomas porque maior transmisión hai habido». Así, a nivel intestinal, os bebés comparten o 50% de cepas coas súas nais, «e a medida que van desenvolvendo actividades motoras, comparten menos coa proxenitora e máis co círculo de persoas con quen se relaciona», apunta. Isto obsérvase no microbioma oral, por exemplo, entre parellas ou amigos, o que fai pensar que a intestinal se obtén, sobre todo, no nacemento, e as outras, a medida que pasan os anos.
Posterior ao asentamento inicial, a adolescencia considérase outro período crucial «no desenvolvemento da microbiota debido aos cambios hormonais», resume Romalde. Na etapa adulta, a comunidade bacteriana do intestino tende a ser estable, «salvo que se produzan alteracións debido a infeccións, tratamentos con antibióticos ou cambios a longo prazo na dieta ou a contorna», apunta o experto da USC.
E, finalmente, a vellez. A idade avanzada implica un envellecemento, e do mesmo xeito que o corazón cumpre anos, tamén o fai a microbiota. «O envellecemento leva asociados cambios fisiolóxicos como a inflamación crónica e a alteración do sistema inmunitario, que modifican a contorna intestinal, afectando a composición do microbioma», explica o profesor da universidade galega.
Desta forma, vólvese menos diverso, sobre todo, a partir dos 60 ou 65 anos. En concreto, observouse unha redución no número de bacterias beneficiosas, como as bifidobacterias, «e un incremento das asociadas á inflamación e as que non son boas, como certos grupos de proteolíticas e bacteroides», apunta o especialista. Ademais, redúcese a produción de ácidos graxos de cadea curta, os cales son vantaxosos, «e un incremento de produtos prexudiciais como o ácido láctico e o metano».
Unha pegada única
Se algo está claro no mundo microscópico é que cada microbiota é única, como unha impresión dixital invisible. O debate está en determinar ata que punto se parecen as dun individuo ou outro. Lluansi precisa que esa semellanza pode chegar ao 80%, con diferenzas no 20% restante. O microbiólogo Ignacio López Goñi, en cambio, rebaixa a cifra ata un 30 % de parecido, o que implicaría un 70% de diversidade.
Pero hai estudos que apuntan a un parecido aínda menor. En análises realizadas a persoas que viven baixo o mesmo teito observouse que a microbiota intestinal pode compartir entre un 10 e un 15% das cepas xenéticas; mentres que a oral, ata un 32%.
Beneficios e futuro
A microbiota humana chegouse a etiquetar como o órgano oculto. É máis, en termos comparativos, sábese que achega máis información que o xenoma humano porque lle supera en números: oito millóns de xenes fronte a 23.000, segundo o Human Microbiome Project. A pesar de a mala fama das bacterias, os microorganismos que viven no corpo humano adoitan ser beneficiosos ou, polo menos, neutrais, xa que establecen unha relación de simbiose: «Nós proporcionámoslles espazo e nutrientes e eles repercuten de xeito positivo no noso organismo. Lonxe de facernos dano, se a microbiota está sa proporciónanos máis beneficios que outra cousa», aclara Cisneros.
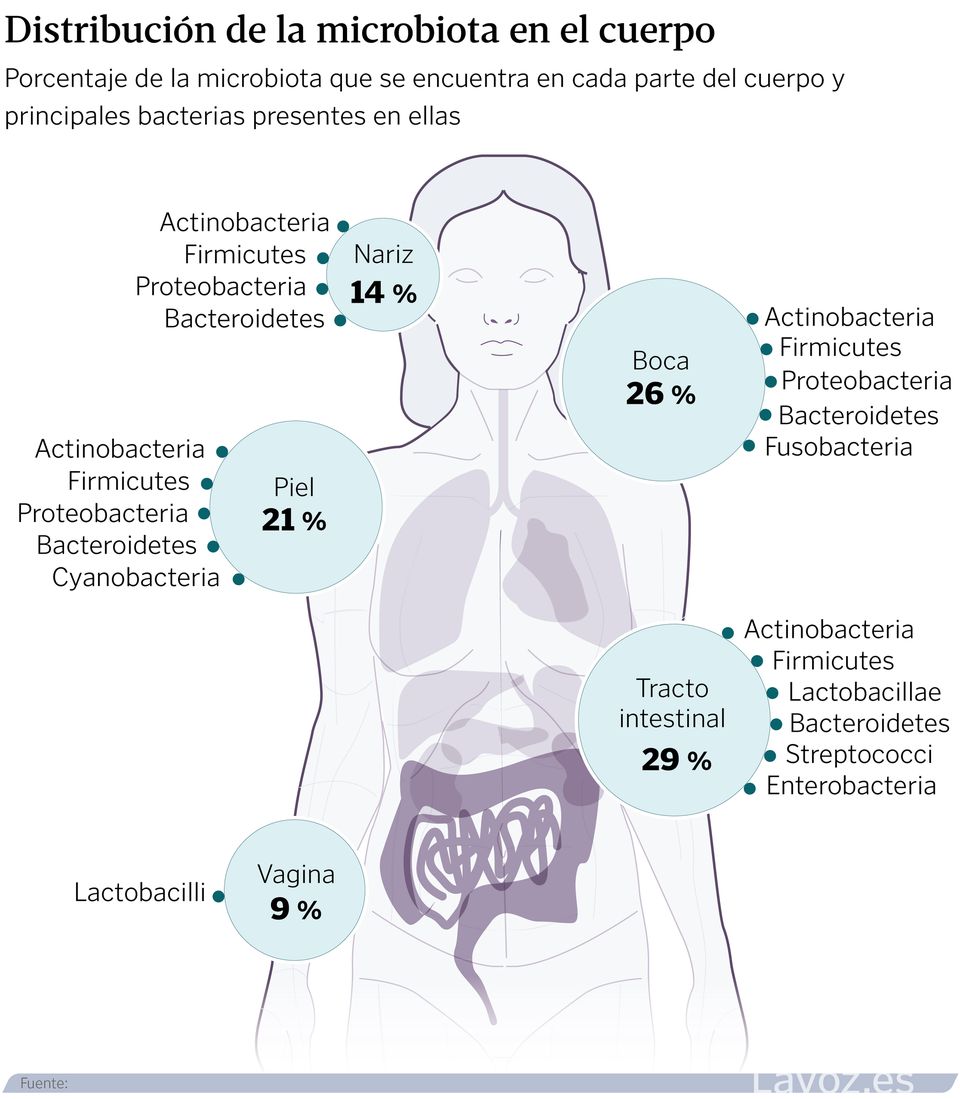
A composición destas comunidades varía segundo a zona do corpo. A día de hoxe, a intestinal considérase a máis importante para a saúde; tamén, a máis poboada. Pola súa banda, a oral divídese en pequenos hábitats: saliva, lingua, superficies dentais, enxivas, mucosa bucal, padal e placa subgingival/supragingival. Este lugar posúe características físicas e químicas que modulan os seus habitantes. Por exemplo, os restos de alimentos que transporta a saliva serven de comida para as bacterias, o que contribúe a que estas se manteñan en niveis estables.
As da pel, tamén con nome propio, poden variar en función da idade, sexo, estado do sistema inmunitario, contorna que lle rodea, e incluso, o uso de medicamentos. Á súa vez, factores como a fricción, a humidade, o sebo ou a exposición solar tamén son importantes. A medida que cambia o seu estado, máis seca nunhas zonas, graxa ou húmida noutras, cambia a súa composición microbiana.
A comunidade do tracto respiratorio é coñecida por formar parte da barreira de defensas e protexer o seu hóspede de infeccións patóxenas. O seu asentamento prodúcese tanto pola interacción con outra microbiota, como pola contorna. As infeccións locais ou a toma de antibióticos.
Daniel Penela, investigador do grupo xa mencionado do Institut de Recerca Sant Joan de Déu, céntrase no estudo da microbiota respiratoria, «unha comunidade que cada vez vai sendo máis coñecida». O seu traballo trata de buscar unha relación entre infeccións respiratorias e as bacterias en idades pediátricas. «Hai nenos que poden ter unha composición que lles predisponga a que estas infeccións sexan máis graves», detalla. Neste tipo, máis aló da colonización inicial que se produce no nacemento, «vacinar aos nenos fai que a microbiota a nivel respiratoria tamén se module, de maneira que crecen as bacterias que son protectoras e minguan as invasoras», engade o científico.
Finalmente, no tracto uroxenital feminino, o xénero Lactobacillus adoita predominar en condicións saudables. Estas bacterias acidifican o ambiente, o que impide a colonización por patóxenos nocivos. Cando ese equilibrio altérase, poden xurdir infeccións como vaginosis, candidiasis, ou cistitis.
Cando se fala das súas posibilidades no medicamento, todos os profesionais consultados falan do futuro. As expectativas postas na microbiota están moi altas. López-Goñi considera que aínda «estamos na idade de pedra». Cando chegue a de ouro, poderase falar de verdadeiros avances: «Podemos pensar que dentro de vinte, trinta ou corenta anos, poderase analizar nosa microbiota e en función dela, e do noso xenoma, poderán deseñarnos un probiótico ou un transplante sintético de determinadas bacterias adecuadas para as nosas patoloxías», avanza.
Romalde asegura que esta comunidade «será clave» no medicamento de precisión, porque o seu estudo «permite personalizar os tratamentos, predicir respostas a fármacos e desenvolver terapias dirixidas». O experto da USC destaca que analizar a composición da microbiota «axuda a identificar biomarcadores de patoloxías, deseñar estratexias de estratificación de pacientes e crear terapias baseadas na súa modulación», aclara en referencia ao uso de probióticos ou transplantes de microbiota fecal. Para o especialista, o coñecemento destas comunidades abre a porta ao desenvolvemento de novas abordaxes dirixidas a enfermidades nas que a microbiota resulte clave, «como a asma ou a obesidade». O exemplo práctico da súa aplicación é o transplante de microbiota fecal, eficaz en trastornos gastrointestinais.

Bacterias intestinais e neuronas, mundos que se entenden
O coñecemento dispoñible sobre a microbiota intestinal permite debuxar un universo aparte e coñecer, en maior profundidade, os seus catro funciones: metabólica, protectora, inmunolóxica e comunicativa. Este conxunto é capaz de fermentar fibra que o intestino non pode degradar, de sintetizar a vitamina K ou de producir ácidos graxos de cadenar curta, con propiedades antiinflamatorias. Tamén evita a colonización doutros patóxenos, adestra ao sistema inmunitario desde o nacemento, estimula a produción de linfocitos e anticorpos, e reforza a barreira intestinal. Ademais, favorece a comunicación con outros órganos, en especial, o cerebro.
Unha relación que, aínda que non se comprende ao completo, deixa pistas de como se produce. «O intestino recibe o nome de segundo cerebro porque alberga máis de 200 millóns de neuronas, que forman o sistema nervioso entérico, que conviven cos miles de millóns de bacterias que compoñen a microbiota intestinal», apunta Celia Herrera-Rincón, investigadora Ramón e Cajal na Facultade de Ciencias Biolóxicas da Universidade Complutense de Madrid, e autora dun estudo, recentemente publicado en Scientific Reports, que permitiu dar un paso máis aló na neurociencia e o intestino.
Ata o momento pensábase que a comunicación entre microbiota e cerebro ocorría de xeito indirecto, a través de moléculas químicas, mediadores do sistema inmune ou nervio vago. Este novo artigo engade unha peza a este quebracabezas: a existencia dunha comunicación directa e inmediata, «baseada no contacto físico entre bacterias e neuronas no uso de sinais bioeléctricas compartidas», que se considera a linguaxe universal das células vivas.
O traballo presenta un modelo experimental que permite observar interaccións en tempo real entre neuronas da cortiza cerebral e Lactiplantibacillus plantarum, unha bacteria común en alimentos fermentados e recoñecida polo seu potencial probiótico.
Herrera describe este achado como un cambio de paradigma no eixo microbiota-cerebro: «O noso traballo achega a primeira evidencia experimental de que a comunicación entre bacterias e neuronas non ten por que limitarse a rutas indirectas, senón que pode ser tamén directa e bioeléctrica», destaca Herrera. Noutras palabras, observaron que unha bacteria viva pode cambiar a actividade dunha neurona con só tocala. Así, viron que este microorganismo «adhírese á superficie das neuronas sen penetralas, e ese simple contacto basta para que as neuronas modifiquen a súa actividade eléctrica, o seu perfil molecular e transcriptómico», sinala Herrera.
Isto significa que unha vez que as neuronas detectan a presenza dunha bacteria, activan programas específicos, «o que demostra que a interacción directa pode deixar unha pegada profunda tanto na fisioloxía como na expresión xénica neuronal».
Dados os resultados obtidos, a investigadora sospeita que este tipo de comunicación podería ser unha linguaxe común na maioría das bacterias: «Ningunhas probablemente utilíceno para potenciar a actividade neuronal e outras para inhibila. O realmente interesante será estudar como responden as neuronas ante bacterias patóxenas ou oportunistas, e se esa interacción directa tamén pode contribuír a explicar certos trastornos neurolóxicos ou do comportamento», adianta a investigadora.
O descubrimento senta as bases para explicar novas formas de como a microbiota modula a función cerebral e abre a porta a tratamentos no futuro: «Deseñar probióticos de nova xeración e terapias baseadas na bioelectricidade, co obxectivo, moi a longo prazo, de mellorar a saúde mental e cognitiva», conclúe a investigadora principal.
