Así funcionan os cabalos de Troia contra o cancro, unha das terapias máis prometedoras contra a enfermidade

ENFERMIDADES

O conxugados anticorpo-fármaco son o exemplo máis estendido destes tratamentos, pero hai proxectos con raíces galegas que agardan mellorar o prognóstico dalgúns tumores
27 nov 2025 . Actualizado á 17:16 h.Na mitoloxía grega, é coñecido o fito do rei Odiseo, metendo en Troia un gran cabalo de madeira que servise como ofrenda á deusa Atenea, cunha sorpresa inesperada: no seu interior había soldados gregos que abriron as portas da cidade e permitiron a entrada do resto do exército, concluíndo na súa conquista. Unha estratexia que se segue utilizando a día de hoxe, nunha enfermidade concreta, o cancro: os cabalos de Troia.
«É unha metáfora coa que describimos unha estratexia de entrega dirixida: terapias que se dirixen especificamente cara ás células tumorais ou a súa microambiente para liberar alí o fármaco activo e reducir o impacto en tecidos sans», explica Rebeca Lozano, secretaria científica da Sociedade Española de Oncoloxía Médica (SEOM) e oncóloga médica do Complexo Asistencial Universitario de Salamanca. Segundo as súas palabras, o exemplo máis estendido son o conxugados anticorpo-fármaco (ADC, polas súas siglas en inglés: antibody-drug conjugate). «Un anticorpo que recoñece unha diana nas células tumorais, se internaliza na célula e libera unha carga citotóxica como pode ser un axente quimioterápico».
Como funcionan as terapias cabalo de Troia
O anticorpo guía ao fármaco directamente ás células tumorais, reducindo o dano aos tecidos sans e funcionando como unha quimioterapia de maior precisión. Así traballan as terapias de cabalos de Troia contra o cancro. «Están dirixidas a tumores sólidos que, pola súa propia natureza, son máis complicados de tratar polas vías convencionais», confirma Xosé Bustelo, profesor de investigación do Consello Superior de Investigacións (CSIC) e director do Centro de Investigación do Cancro de Salamanca.
Como o fan? «Están a explorarse múltiples vías», avanza o experto. «Quizais as máis habituais sexan as de utilizar nanopartículas que alberguen dentro delas axentes químicos ou biolóxicos como anticorpos co fin de que penetren nas células tumorais, liberen o seu contido e destrúan as células tumorais. Incluso se pode falar doutro tipo, como algúns virus oncolíticos, que se deseñan para destruír esas células e, ao mesmo tempo, que liberen material que sirva para estimular ao propio sistema inmune do paciente».
Lozano indica que algúns ADC incluso presentan un efecto «bystander» (en inglés, espectador): «Parte da carga pode difundirse a células tumorais veciñas que non expresan a diana, o que axuda a abordar a heteroxeneidade intratumoral. O obxectivo é aumentar a concentración intratumoral do axente activo e reducir a toxicidade sistémica». De feito, confirma que tamén se lles chama «balas máxicas», porque «combinan a capacidade do anticorpo para dirixirse selectivamente ao tumor coa potencia dos axentes citotóxicos».
É dicir, un dos obxectivos destas terapias dirixidas contra o cancro é evitar danar células sas ademais das cancerosas, o que causa numerosos efectos secundarios. «Creo que esa sempre foi a ambición da oncoloxía. Facer que os tratamentos, incluso aqueles non selectivos como as quimioterapias, sexan cada vez máis específicos e induzan menos efectos colaterais», conta Bustelo. Non só se trata de evitalos durante todo o proceso que dure o tratamento, senón que, unha vez que o paciente se curou, a súa calidade de vida tampouco se viu afectada polos efectos adversos que poden permanecer presentes unha vez concluído. «Sobre todo neste momento, onde estamos a aumentar cada vez máis a supervivencia dos pacientes», engade o experto.
Mentres que a quimioterapia tradicional diríxese indistintamente ás células en división, os ADC administran fármacos de forma selectiva ás células cancerosas, preservando ás sas. Así, redúcense os efectos secundarios.
Este tipo de terapias non son o mesmo que a inmunoterapia. «Os ADC son un tipo de terapia máis dirixida que transportan unha carga citotóxica, mentres que por inmunoterapia entendemos, principalmente, os inhibidores de punto de control inmune, vacinas ou terapias celular, cuxo mecanismo de acción é diferente», asegura Lozano. Así, aínda que existen combinacións e áreas de interacción biolóxica, non son equivalentes. «Non todos os cabalos de Troia son inmunoterapias, pero si que ningúns deles utilizan as inmunoterapias como forma de destruír a célula tumoral ou activar o sistema inmune para que a célula tumoral destrúase máis efectivamente», engade Bustelo.
A que tipo de tumores están dirixidos
A día de hoxe existen ADC con diferentes indicacións. Lozano menciona para o cancro de mama, uroterial (de vexiga e vías urinarias), de pulmón e tumores hematolóxicos. «A selección de pacientes adoita requirir biomarcadores específicos, pero non sempre é así».
En España xa existen varios ADC autorizados pola Axencia Europea de Medicamentos (EMA) e con Informes de Posicionamento Terapéutica (IPT) publicado pola Axencia Española de Medicamentos e Produtos Sanitarios (AEMPS). «O seu uso réxese por esas indicacións e as decisións de financiamento do Sistema Nacional de Saúde. Entre eles, atópanse: trastuzumbab emtasina (T-DM1) e trastuzumab deruxtecán con indicación en cancro de mama», sostén Lozano.
Pondo o foco no primeiro (aínda que o mecanismo de acción é similar nos dous), o trastuzumbab é un anticorpo que se une á proteína HER2, que se atopa en grandes cantidades na superficie dalgunhas células de cancro de mama, detendo o seu crecemento. Unha vez que este se une á célula cancerosa, a emtansina é liberada dentro da célula, destruíndo as células tumorais.
Tamén contra o cancro de mama avanzado está aprobado o sacituzumab govitecan, pero neste caso, para o tipo triplo negativo e o HR+/HER2-, xa en metástase. Mentres que para o carcinoma uroterial (cancro de vexiga e vías urinarias), está dispoñible o enfortumbab vedotina. Úsase naqueles casos nos que o tumor se diseminou ou xa non pode extirparse cirurxicamente. É dicir, de última liña, para estadios avanzados. «Neste caso, o seu uso non require determinación deste biomarcador, dado que a diana está altamente sobreexpresada neste tipo de tumor», menciona Lozano.
A dispoñibilidade concreta e as condicións de uso deben consultarse nos Informes de Posicionamento Terapéutico (IPT) e resolucións vixentes, xa que poden ir modificándose.
Cápsulas con células CAR-T, unha terapia prometedora en investigación
Ata o de agora, os linfocitos T modificados xeneticamente, denominados de xeito científico como células CAR-T, xa poden recoñecer moléculas especificamente expresadas en células tumorais e, posteriormente, promover a súa destrución. É un tipo de tratamento que xa forma parte do abano terapéutico daqueles pacientes que presenten tumores hematolóxicos, derivados de células do sangue. Con todo, a súa efectividade contra tumores sólidos é moi baixa.
Por iso, un proxecto con investigadores do CSIC está a estudar o desenvolvemento de cápsulas biolóxicas nas que se albergarán estas células CAR-T coas que tratar de forma específica este tipo de tumores sólidos. Nel participan o Centro de Investigación contra o Cancro de Salamanca (CIC, un instituto mixto de investigación do CSIC e a Universidade de Salamanca), o Centro de Investigación Biomédica en Rede de Cancro (CIBERONC), a Universidade de Santiago de Compostela (USC), o Centro de Fabricación de Terapias Avanzadas de Galicia (GALARIA), e o CIMA Universidade de Navarra.
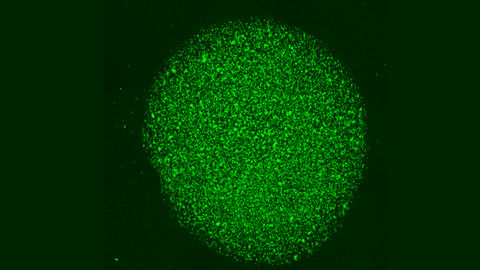

José Rivas Rey, coordinador do proxecto e catedrático do Departamento de Física Aplicada da Universidade de Santiago de Compostela, confesa que o principal reto deste proxecto, que finaliza este ano, foi «que esas células CAR-T liberásense e mantivesen vivas e activas na cápsula durante tempos prolongados». Para entendelo mellor, detalla que, primeiro, elaboraron as cápsulas cun polímero natural que «funciona como un colector de dous ou tres milímetros dentro das cales van embebidas as células CAR-T cun cóctel de moléculas bioactivas que as mantén vivas e activas». As células multiplícanse dentro das cápsulas e «poden saír durante máis de vinte días, o que permite o seu uso localizado dentro do tumor durante tempos prolongados».
A boa noticia, remarca Rivas, é que os resultados son positivos. «Fixemos un estudo in vivo, con resultados moi positivos. Estamos moi contentos porque os tumores se reduciron, necesitándose para iso números de células CAR-T moi inferiores a cando estas se administran no torrente circulatorio como é habitual». Aínda que, opta pola prudencia: «Que funcione neste ámbito, ata chegar á clínica, falta un gran paso». Do mesmo xeito que Troia non se conquistou nun ano, estas biocápsulas con células CAR-T tamén necesitan tempo para acabar cos tumores sólidos. «En dous ou tres meses remataremos este proxecto no que levamos tres anos e os resultados son prometedores, pero aínda quedan moitos controis e maduración», comenta Rivas.
Xosé Bustelo tamén é un dos investigadores principais deste proxecto. «Creo que o interesante deste desenvolvemento, que ata o de agora é soamente preclínico, é permitirnos levar directamente as células CAR-T de forma activa ao tumor sólido sen que estas se dispersen por todo o organismo, senón que xustamente queden alí onde son necesarias para a súa función. Co cal, temos máis soldados no campo de batalla que se utilizamos CAR-T "normais". Outro punto importante é que ese «biocóctel» que se atopa nestas cápsulas ten un ámbito de acción local, «o que evita efectos secundarios negativos como é a indución de reaccións inflamatorias a nivel de organismo», conclúe.